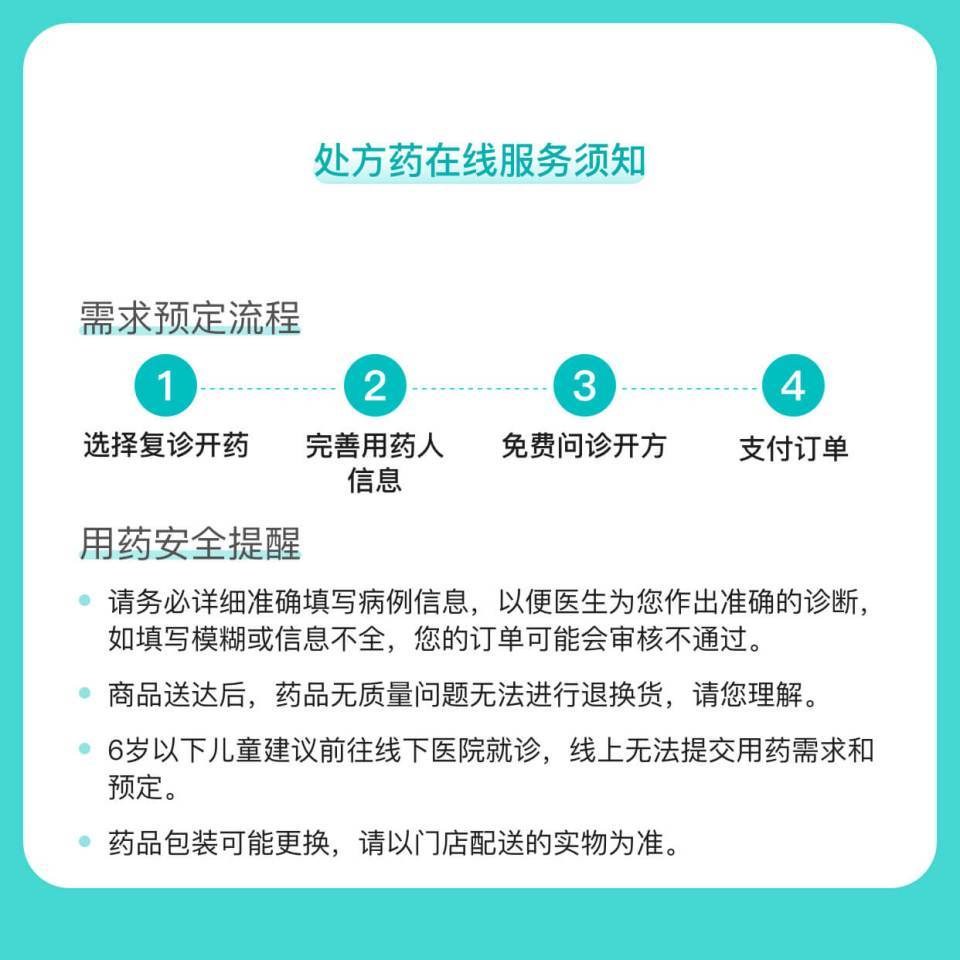
商品信息
药品通用名
盐酸度洛西汀肠溶片
产品规格
20mg*24片/盒
品牌
恩华
批准文号
国药准字H20130056
适用人群
男性、女性
禁忌
过敏:度洛西汀肠溶片禁用于已知对度洛西汀或产品中任何非活性成分过敏的患者。单胺氧化酶抑制剂:禁止与MAOI联用,因为与5-羟色胺药物之间存在严重的、有时是致命的相互作用,包括高热、僵硬、肌阵挛、自主神经功能紊乱,可能伴有生命体征迅速波动,精神状态改变,包括极度激越进展到谵妄和昏迷。这些反应在停用5-羟色胺再摄取抑制剂后即开始MAOI治疗的患者也有报道。有些病例呈现神经阻滞剂恶性综合征的表现。未经治疗的窄角型青光眼:临床试验显示,度洛西汀有增加瞳孔散大的风险,因此,未经治疗的窄角型青光眼患者应避免使用度洛西汀。
处方类型
处方
生产厂家名称
江苏恩华药业股份有限公司
生产厂家地址
徐州市经济开发区杨山路18号
性状
本品为肠溶包衣片,除去包衣后显类白色。
成分
(S)-(+)-N-甲基-3-(1-萘氧基)-3-(2-噻吩基)丙胺盐酸盐。
注意事项
临床恶化和自杀风险
成年、儿童抑郁症患者,无论是否接受抗抑郁药物治疗,都可能发生抑郁症状恶化和/或出现自杀想法与自杀行为(自杀)或行为的异常改变,在病情显著缓解前这种风险将持续存在。自杀是抑郁症及其它精神疾病伴有的风险,这些疾病本身是自杀的最明显前兆。长期以来认为某些特定人群的治疗早期,抗抑郁药物可能会诱发抑郁症状恶化或导致自杀。
综合分析抗抑郁药物短期安慰剂对照试验(SSRI及其它抗抑郁药)表明,抗抑郁药增加患有抑郁症及其它精神疾病的儿童、青少年和年轻成人(年龄为18-24岁)的自杀想法和自杀行为(自杀)的风险。短期研究还显示,与安慰剂相比,抗抑郁药不增加年龄大于24岁成人的自杀风险;与安慰剂相比,抗抑郁药治疗降低年龄大于65岁成人患者的自杀风险。详见说明书。
剂型
片剂
产地类型
国产
不良反应
所有适应症的不良反应见下表:表格见说明书。注解:1. 此数据来源于2011年10月19日前安慰剂对照的数据库,包括已批准的适应症及其它条件下已完成的临床研究。2. 包括应激性、急迫性和混合性尿失禁。3. 包括慢性背痛和骨关节炎。4.上腹部疼痛、下腹部疼痛、腹部压痛、腹部不适、胃肠道疼痛。5. 包括腹泻出血、下胃肠道出血、呕血、便血、肛门出血、黑粪症、直肠出血、溃疡出血。6. 包括无力。7. 在年长患者中跌倒更加普遍(≥65岁)8. 包括收缩压升高、舒张压升高、收缩期高血压、舒张期高血压、高血压危象、原发性高血压和高血压。9. 丙氨酸氨基转移酶(ALT)升高、肝酶升高、天门冬氨酸氨基转移酶(AST)升高、肝功能测试异常、-氨基丁酸氨基转移酶升高、血碱性磷酸酶升高、血胆红素升高、肝酶异常。10. 包括厌食症。11. 肌肉骨骼僵硬。12. 肌痛、颈痛。13. 睡眠过度、镇静。14.包含感觉减退,面部感觉减退,生殖器感觉迟钝和口腔感觉异常。15.中段失眠、终期失眠症和初段失眠。16. 包含快感缺失。17. 性欲缺乏。18. 紧张不安感、坐立不安、紧张、精神运动过度。19.意识模糊状态。20. 梦魇。21. 射精失败。22. 包括热潮红。一般不良反应头晕、恶心、头疼,也见于度洛西汀停药后,发生率≥ 5%。在安慰剂对照的临床试验中,度洛西汀治疗伴随小的ALT、AST、肌酸磷酸激酶(CPK)和钾离子从基线至终点平均值升高;与对照组相比,度洛西汀治疗的患者可有罕见的、暂时的异常值。血糖调整―在3项治疗糖尿病周围神经痛的临床试验中,平均糖尿病持续时间为12年,平均空腹血糖基线值为176mg/dL,平均糖化血红蛋白(HbA1c)基线值为7.81%。在这3项试验的最初12周急性治疗期,度洛西汀治疗组患者的空腹血糖可见小幅升高。HbA1c在度洛西汀治疗组和安慰剂对照组均稳定。在治疗持续到52周时,度洛西汀治疗组和安慰剂组均出现HbA1c升高,度洛西汀治疗组平均增高值比安慰剂组高0.3%。尽管常规治疗组患者显示轻度降低,但空腹血糖和总胆固醇显示小幅增高。详见说明书。
贮藏
遮光,密封,阴凉(不超过20℃)处保存。
最大可购买盒数
20
儿童注意事项
对于儿童患者的疗效和安全性尚不清楚。如果考虑在儿童青少年中使用度洛西汀,必
须权衡潜在的风险和临床需要。
老人注意事项
在参与度洛西汀治疗抑郁症的临床研究的2418例患者中,5.9%(143)为65岁或以上年龄的患者。在治疗广泛性焦虑障碍的临床研究中,没有包括足够数量的65岁或65岁以上患者,不能确定老年患者的应答是否与年轻患者有所区别。这些患者和年轻患者间未观察到安全性和疗效方面的显著差异,其他临床方面的报告也没有发现老年人群和年轻人之间的明显差异,但不能排除某些老年患者的敏感性增高。包括度洛西汀在内的SSRI和SNRI与老年患者中出现的有临床意义的低钠血症相关。所有安慰剂对照研究中,对65岁或65岁以上患者(N=3278)进行亚组分析,度洛西汀组中1.1%的患者报告1例或1例以上的跌倒,安慰剂组中有0.4%的患者报告此信息。然而,许多出现跌倒的患者具有跌倒相关的潜在风险因素(如药物影响、合并用药、步态紊乱),这些因素对跌到的影响尚不清楚。已报道的跌到的严重后果包括骨折和住院治疗。
比较健康老年女性(65-77岁)与健康中年女性(32-50岁)单次口服40mg度洛西汀后的药代动力学,其最大血浆浓度(Cmax)无差异,但老年女性的血药浓度-时间曲线下面积(AUC)稍高(约25%),并且半衰期延长4小时。人群药代动力学分析提示:从25至75岁中,年龄每增加1岁,药物清除率下降约1%。但是年龄作为一个预测因素,仅能解释患者间个体变异的很小部分。无须根据年龄调整剂量。详见说明书。
妊娠与哺乳期注意事项
妊娠:致畸作用,妊娠分类C-在动物生殖研究中,发现度洛西汀对胚胎/胎儿和出生后的发育有不良影响。怀孕大鼠和家兔在胚胎的器官发生期口服度洛西汀,剂量达45mg/kg/日时(大鼠剂量为7倍于最大人类推荐剂量MRHD,60mg/kg/日】,4倍于按照体重体表面积指数计算的人体剂量120ng/日;家兔的剂量为15倍于MHD,7倍于按照体重体表面积指数计算的人体剂量120mg/日),未发现有数畸作用。但这个剂量时,胎儿体重降低。无效应剂量为10mg/kg/日(在大鼠为2倍于MRHD,约1倍于按照体重/体表面积指数计算的人体剂量120mg/日;家兔的剂量为3倍于MRHD,约2倍于按照体重体表面积指数计算的人体剂量120mg/日)。妊娠大鼠在整个孕期和哺乳期给予口服度洛西汀,在剂量30mg/kg/日时(5倍于MPHD,2倍于技照体重/体表面积指数mg/m²计算的人体剂量120mg/日),幼崽出生后存活1天、出生时和哺乳期的体重下降;无效应剂量为10mg/kg日。而且,母体使用度洛西汀的剂量达到30mg/kg/日时,幼崽的行为表现与反应性的增高一致,如对噪音的惊诧反应增强,自主活动的习惯性降低。但母体使用度洛西汀对子代断奶后的生长和生殖行为没有负面影响。由于缺乏足够的、设计良好的孕期女性对照研究,因此,只有在权衡对胎儿潜在的受益超过风险时,才考虑在母孕期使用度洛西汀。近期服用度洛西汀的母亲,其新生儿可能发生如下停药症状,包括肌张力下降、震颤、紧张不安、喂养困难、呼吸窘迫和痫发作。详见说明书。
有效期
24个月
图文介绍






消费者告知
百度健康商城为网络交易服务平台,提供平台技术服务。商家提供商品信息展示、配送、质量安全保障等。
依据《药品经营质量管理规范》,为保障患者用药安全,除药品质量原因外,药品一经售出,不退不换。
依据《药品经营质量管理规范》,为保障患者用药安全,除药品质量原因外,药品一经售出,不退不换。
价格说明
划线价格:指商品的专柜价、吊牌价、正品零售价、厂商指导价或该商品的曾经展示过的销售价等,并非原价,仅供参考。
未划线价格:指商品的实时标价,不因表述的差异改变性质。具体成交价格根据商品参加活动,或使用优惠券等发生变化,最终以订单结算页价格为准
未划线价格:指商品的实时标价,不因表述的差异改变性质。具体成交价格根据商品参加活动,或使用优惠券等发生变化,最终以订单结算页价格为准
如何查询订单?
您可以在百度APP-我的-订单,找到您的商品订单。
如何申请退款?
您可以在百度APP-我的-订单,找到您需要退款的商品订单,在订单详情页选择“退款”,按照指引流程进行操作即可。退款成功后,您的资金将原路返回您的支付账号,因不同银行处理时间不同,预计1~5个工作日内到账。
如何查找小程序?
打开百度 App,搜索「百度健康商城」即可直达小程序
商品评价(2)
查看全部
1***1
20mg*12片*2板/盒
#正品#质量好该用户觉得商品很好,给出了5星好评
1***1
20mg*12片*2板/盒
#正品#质量好该用户觉得商品很好,给出了5星好评
看了又看
店铺推荐