



处方药
[瑞夫恩]恩替卡韦分散片 0.5mg*7片*3板/盒
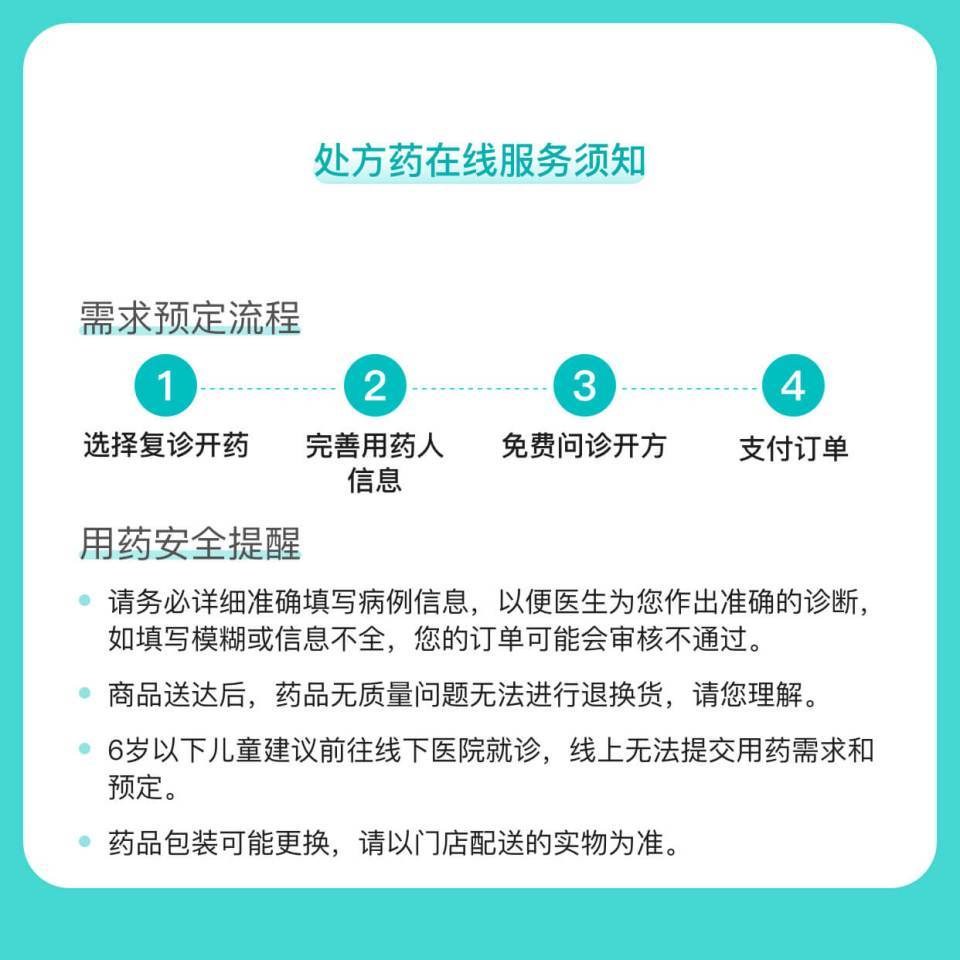
处方药须凭处方在药师指导下购买和使用。
¥
19
已售3698件
排行 「肝炎/病毒性肝炎用药热销榜」TOP5
「肝炎/病毒性肝炎用药热销榜」TOP5
图文介绍




消费者告知
百度健康商城为网络交易服务平台,提供平台技术服务。商家提供商品信息展示、配送、质量安全保障等。
依据《药品经营质量管理规范》,为保障患者用药安全,除药品质量原因外,药品一经售出,不退不换。
依据《药品经营质量管理规范》,为保障患者用药安全,除药品质量原因外,药品一经售出,不退不换。
价格说明
划线价格:指商品的专柜价、吊牌价、正品零售价、厂商指导价或该商品的曾经展示过的销售价等,并非原价,仅供参考。
未划线价格:指商品的实时标价,不因表述的差异改变性质。具体成交价格根据商品参加活动,或使用优惠券等发生变化,最终以订单结算页价格为准
未划线价格:指商品的实时标价,不因表述的差异改变性质。具体成交价格根据商品参加活动,或使用优惠券等发生变化,最终以订单结算页价格为准
如何查询订单?
您可以在百度APP-我的-订单,找到您的商品订单。
如何申请退款?
您可以在百度APP-我的-订单,找到您需要退款的商品订单,在订单详情页选择“退款”,按照指引流程进行操作即可。退款成功后,您的资金将原路返回您的支付账号,因不同银行处理时间不同,预计1~5个工作日内到账。
如何查找小程序?
打开百度 App,搜索「百度健康商城」即可直达小程序
商品评价(916)
查看全部

1***1
0.5mgx7片x3板/盒
#正品#效果不错#图文相符#包装严实#物流快#回复很快在百度第一次买药,恩替卡韦和医院价格差不的物流很快,快递小哥态度很好。


1***9
0.5mg*21片
物流快,包装好,对购药信息,规定挺严格具体药效待用一个月后再做评价🙏这次购买的和之前在医院买的药是一个厂家生产的,里外包装都是一样的但愿效果也是好的🙏




1***4
0.5mg*7片*3板/盒
#实惠34岁六七岁的乙肝那个时候家里没告诉我,二十多年了,直到读初中时学校体检发现才知道自己有乙肝那时候治疗吃中成药中药很麻烦大三阳经过两年治疗变成了小三阳之后一直没管滴酒不沾很少买包装食品来吃,前段时候医生说我的情况刚好达到吃标准,要我自己考虑用不用药,经过仔细考虑还是服用恩替卡韦,这个药方便,经济负担轻,吃一段时间等病毒量降下来尝试抗原转阴,

1***3
0.5mg*21片
#图文相符#包装严实#物流快得了。得了病。必须要吃得药,前一段也吃过。这个品牌的药。现在又够了五盒。医生嘱咐。必须得。一直要吃。要吃。吃一段时间再看看效果吧。坚持。坚持。

1***0
0.5mgx7片x3板/盒
正品质量好效果好图文相符包装严实物流很快客服太度很好。物流很快十分满意。

和***3
0.5mg*21片
#正品#实惠#质量好#效果不错#图文相符#包装严实#物流快#回复很快药不错,广大病友的福音,希望更多的病友能得到此药的护佑,身体健康!
看了又看
店铺推荐











