




处方药
[欣百达]盐酸度洛西汀肠溶胶囊 30mg*7粒/盒
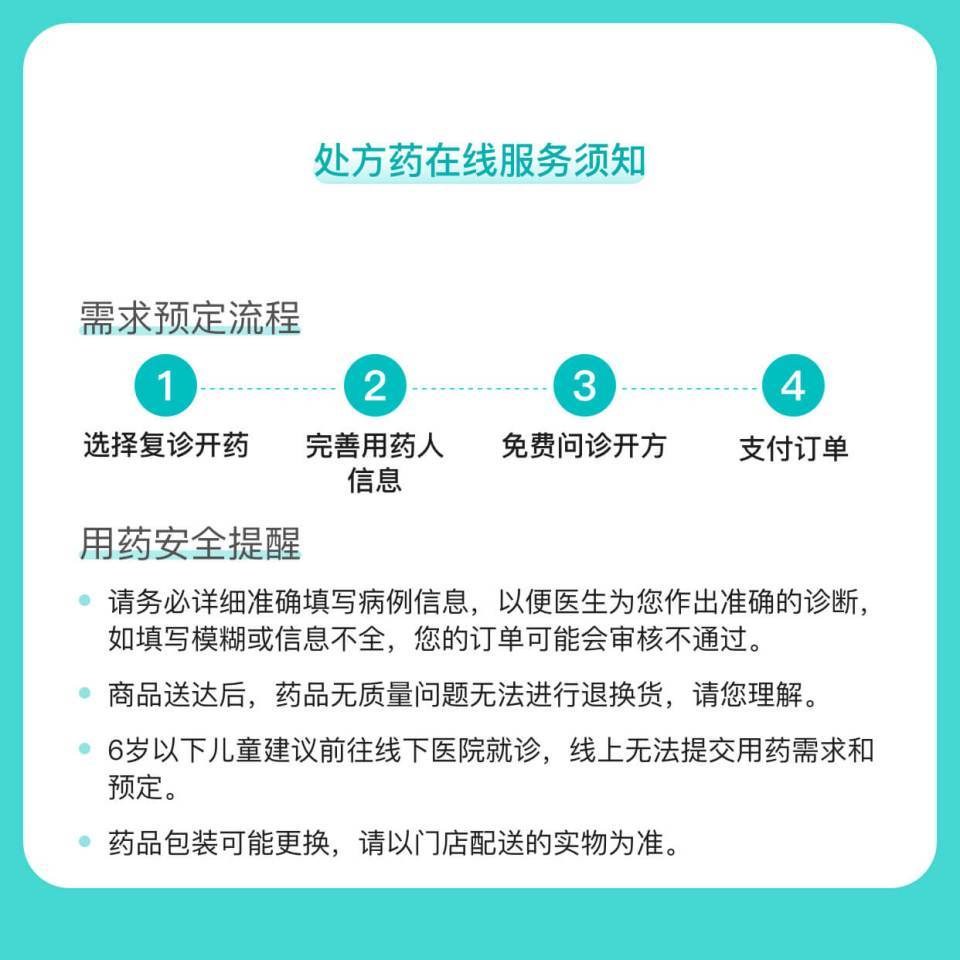
处方药须凭处方在药师指导下购买和使用。
本品为高风险药品,为保障您的用药安全,请您向医生问诊后,在药师的指导下服用。
¥
60.8

商品信息
药品通用名
盐酸度洛西汀肠溶胶囊
产品规格
30mg*7粒/盒
品牌
礼来
批准文号
H20150284
适用人群
成人
禁忌
过敏:度洛西汀肠溶胶囊禁用于已知对度洛西汀或产品中任何非活性成分过敏的患者。单胺氧化酶抑制剂:由于增加发生五羟色胺综合征的危险,所以将要服用本品治疗精神疾病或停用本品5天内,禁用MAOIs。MAOIs停药14天内也应禁用本品。由于增加发生五羟色胺综合征的危险,所以正在使用MAOIs(如利奈唑胺或静脉注射亚甲基蓝)的患者也应禁用本品。未经治疗的窄角型青光眼:临床试验显示,度洛西汀有增加瞳孔散大的风险,因此,未经治疗的窄角型青光眼患者应避免使用度洛西汀。
处方类型
处方
生产厂家名称
LILLY DEL CARIBE,INC.
生产厂家地址
Puerto Rico Industrial Park 12.6 KM 65th Infantry Road,Carolina,Puerto Rico 00985
性状
详见说明书
成分
主要组成成分:盐酸度洛西汀
注意事项
儿童、青少年和年轻成人的自杀想法和自杀行为成年、儿童抑郁症患者,无论是否接受抗抑郁药物治疗,都可能发生抑郁症状恶化和/或出现自杀意念与自杀行为(自杀)或异常的行为改变,在病情显著缓解前这种风险将持续存在。自杀是抑郁症及其它精神疾病伴有的已知风险,这些疾病本身是自杀的最明显前兆。长期以来认为某些特定人群的治疗早期,抗抑郁药物可能会诱发抑郁症状恶化或导致自杀。综合分析抗抑郁药物短期安慰剂对照试验(SSRI及其它抗抑郁药)表明,抗抑郁药增加患有抑郁症(MDD)及其它精神疾病的儿童、青少年和年轻成人(年龄为18-24岁)的自杀意念和自杀行为(自杀)的风险。短期研究还显示,与安慰剂相比,抗抑郁药不增加年龄大于24岁成人的自杀风险;与安慰剂相比,抗抑郁药治疗降低年龄为65岁及以上成人患者的自杀风险。对9种抗抑郁药(SSRI和其它抗抑郁药)治疗儿童青少年抑郁症、强迫症或其他精神障碍的安慰剂对照试验(总计24个试验包括4400例患者)的综合分析,以及对11种抗抑郁药安慰剂对照试验(总计295个短期试验,治疗期中位数2个月,包括了超过77000名患者)的综合分析结果表明,各种药物治疗引起的自杀风险存在相当大的差异,不过,几乎对于所有研究药物,较年轻的患者发生自杀的风险均有增加趋势。不同适应症间的绝对自杀风险不同,其中最高的是抑郁症。自杀风险差异(每1000个患者中治疗药物与安慰剂自杀例数差异)见下表:表格及其他内容详见说明书。
剂型
胶囊剂
商品名
欣百达
产地类型
进口
不良反应
中国尚未批准盐酸度洛西汀肠溶胶囊用于除抑郁症、广泛性焦虑障碍和慢性肌肉骨骼疼痛之外的其他适应症。以下不良反应内容来自本品国外说明书中【不良反应】信息。1 临床试验数据来源:与临床实践相比,临床试验是在非常不一样的情况下进行的,所以在一种药物的临床试验中观察到的不良反应发生率不能直接与另一种药物的临床试验中观察到的不良反应发生率直接进行比较,并且不能反映出在临床实践中的发生率。报道的不良反应发生率代表的是至少发生一例列出类型的治疗中出现的不良反应的患者比例。如果不良反应是在基线评价后接受治疗时首次发生或加重的,则认为该反应是在治疗中出现的。临床研究期间报告的反应不一定是由治疗引起的,且频率并不能反映研究者对因果关系的印象(评估)。成人 —下列数据反映了在治疗抑郁症(N = 3779)、广泛性焦虑障碍(N = 1018)、骨关节炎(N=503)、慢性腰背痛(N=600)、糖尿病性周围神经痛(N = 906)和纤维肌痛(N = 1294)的安慰剂对照试验中,患者对度洛西汀的暴露情况。研究人群的年龄为17至89岁;在抑郁症、广泛性焦虑障碍、骨关节炎和慢性腰背痛 、糖尿病性周围神经痛和纤维肌痛患者中,分别有65.7%、60.8%、60.6%、42.9%和94.4%为女性;并且分别有81.8%、72.6%、85.3%、74.0%和85.7%为白人。大多数患者接受的度洛西汀日总剂量为60 mg至120 mg。下列数据不包括在≥ 65岁的患者中开展的旨在评估度洛西汀对广泛性焦虑障碍疗效的试验结果;不过,该老年患者人群观察到的不良反应通常与总体成年人群观察到的不良反应相似。2 在成人安慰剂对照试验中报告的导致治疗终止的不良反应:抑郁症 - 在治疗抑郁症安慰剂对照试验中,度洛西汀治疗组大约有8.4%(319/3779)的患者因不良反应导致治疗终止,与之相比,安慰剂治疗组有4.6%(117/2536)的患者因不良反应导致治疗终止。恶心(度洛西汀组为1.1%,安慰剂组为0.4%)是被报告的导致治疗终止的唯一常见不良反应,且被认为是与药物治疗相关(如度洛西汀组有至少1%的患者因此停止治疗,且发生率至少为安慰剂组的2倍)。详见说明书。
贮藏
15~30℃室温保存。
最大可购买盒数
30
儿童注意事项
本品在中国18岁以下儿童及青少年患者中用药的疗效及安全性尚未确立。
老人注意事项
在度洛西汀治疗抑郁症(MDD)的上市前临床研究中,2,418名患者中有5.9%(143)为65岁或65岁以上。在治疗慢性腰背痛(CLBP)的上市前研究的1041名患者中,21.2%(221)的患者为65岁或65岁以上。在治疗骨关节炎(OA)的上市前研究的487名患者中,40.5%(197)的患者为65岁或65岁以上。在治疗糖尿病性周围神经痛(DPNP)的上市前研究的1,074名患者中,33%(357)的患者为65岁或65岁以上。在纤维肌痛(FM)上市前研究的1,761患者中,7.9%(140)的患者为65岁或65岁以上。治疗MDD、GAD、DPNP、FM、OA和CLBP研究中,总体上,这些患者和年轻患者间未观察到安全性和疗效方面的显著差异,其他临床方面的报告也没有发现老年人群和年轻人之间的明显差异,但不能排除某些老年患者的敏感性增高。包括度洛西汀在内的SSRI和SNRI与老年患者中出现的有临床意义的低钠血症相关。对所有参加安慰剂对照研究的患者进行分析,度洛西汀组患者的跌倒率高于安慰剂组。跌倒风险的增加与患者具有的跌倒相关的潜在风险成正比,且随着年龄的增长而增加。因为合并用药、共存疾病和步态紊乱等跌倒相关风险因素在老年人中更普遍的存在,所以在度洛西汀的治疗过程中,年龄增长本身对跌倒的影响尚不清楚。已报道的跌倒的严重后果包括骨折和住院治疗。比较健康老年女性(65~77岁)与健康中年女性(32~50岁)单次口服40mg度洛西汀后的药代动力学,其最大血浆浓度(Cmax)无差异,但老年女性的血药浓度-时间曲线下面积(AUC)稍高(约25%),并且半衰期延长4小时。人群药代动力学分析提示:从 25至75岁中,年龄每增加1岁,药物清除率下降约1% 。但是年龄作为一个预测因素,仅能解释患者间个体变异的很小部分。无须根据年龄调整剂量。
妊娠与哺乳期注意事项
妊娠:致畸作用,属FDA妊娠安全分级C类。风险总结 — 孕妇的度洛西汀用药情况尚没有足够的、良好对照的研究。只有在证明胎儿的潜在获益大于潜在风险时,才应考虑在孕期中使用度洛西汀。临床考虑:胎儿/新生儿不良反应—孕期内暴露五羟色胺-去甲肾上腺素再摄取抑制剂(SNRIs)或选择性五羟色胺再摄取抑制剂(SSRIs)的新生儿已发生出现并发症导致住院时间延长、需要呼吸支持和管道喂食,这些并发症可在出生后立刻发生。已报道的临床发现包括呼吸窘迫、紫绀、呼吸暂停、癫痫发作、体温不稳、喂养困难、呕吐、低血糖、肌张力下降、肌张力增加、反射亢进、震颤、神经过敏、易怒、哭闹不止。这些情况可能是SNRIs或SSRIs的直接毒性作用所致,或者可能是停药综合征。应当注意的是,在有些病例中,其临床表现与五羟色胺综合征一致。哺乳妇女:风险总结:本品可分泌进入乳汁内。在一项已发表的研究中,对婴儿正在断奶的哺乳期妇女给予本品。稳态时,乳汁中的度洛西汀浓度约为母体血浆浓度的25%。估计婴儿间接接受的日剂量大约为母亲用药剂量的0.14%。应结合考虑母乳喂养的发育和健康益处、母亲对本品的临床需求以及本品或母亲的基础状况对母乳喂养儿童的任何潜在不利影响。哺乳期妇女应慎用本品。数据:在6名产后至少12周并选择对其婴儿断奶的哺乳期女性中对度洛西汀的分布进行了研究。按度洛西汀40mg 一日二次的剂量连续用药3.5天, 乳汁中测得峰浓度的中位时间为给药后3小时。在接受该剂量治疗时,乳汁中的度洛西汀量约为7 mcg/天;婴儿的日剂量估计约为2 mcg/kg/天。未检测度洛西汀代谢产物在乳汁中的分泌情况。
有效期
36个月
图文介绍





消费者告知
百度健康商城为网络交易服务平台,提供平台技术服务。商家提供商品信息展示、配送、质量安全保障等。
依据《药品经营质量管理规范》,为保障患者用药安全,除药品质量原因外,药品一经售出,不退不换。
依据《药品经营质量管理规范》,为保障患者用药安全,除药品质量原因外,药品一经售出,不退不换。
价格说明
划线价格:指商品的专柜价、吊牌价、正品零售价、厂商指导价或该商品的曾经展示过的销售价等,并非原价,仅供参考。
未划线价格:指商品的实时标价,不因表述的差异改变性质。具体成交价格根据商品参加活动,或使用优惠券等发生变化,最终以订单结算页价格为准
未划线价格:指商品的实时标价,不因表述的差异改变性质。具体成交价格根据商品参加活动,或使用优惠券等发生变化,最终以订单结算页价格为准
如何查询订单?
您可以在百度APP-我的-订单,找到您的商品订单。
如何申请退款?
您可以在百度APP-我的-订单,找到您需要退款的商品订单,在订单详情页选择“退款”,按照指引流程进行操作即可。退款成功后,您的资金将原路返回您的支付账号,因不同银行处理时间不同,预计1~5个工作日内到账。
如何查找小程序?
打开百度 App,搜索「百度健康商城」即可直达小程序
看了又看
店铺推荐













